近日,为应对疫情爆发期间的个人防护用品以及医疗器械的短缺问题,美国发布EUA(应急使用授权),前提是要确保产品达到足够的健康和安全水平。
目前已经列入EUA的包括(新冠检测试剂、口罩、呼吸机设备等),EUA名录持续更新中。
美国医疗器械是由食品药品监督管理局(FDA)管理批准上市。
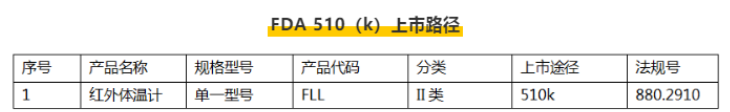
医用口罩、电子体温计、红外体温计(额温枪)都属于Ⅱ类医疗器械,需要按FDA510_(k)方式申请。
EUA只是加快了产品审核流程
在体温计还没有被列入EUA的当下
贝斯通商品检验建议:
无论EUA名录如何变动,产品都以合规为前提,体温计生产商应提前启动FDA合规准备工作(产品检测+FDA510(k)文件准备),一旦应急上市途径明确,在产品合规的前提下,产品通过FDA EUA)应急审批即可出货清关。
贝斯通商品检验能提供
体温计FDACE等加急检测服务欢迎咨询!
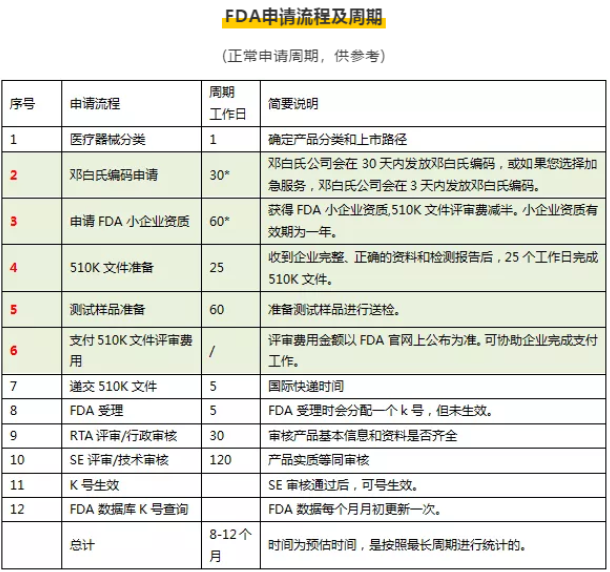
FDA510(k)申请流程
1.FDA510(k)文件准备2.产品检测---510(k)递交申请
3.FDA根据产品类型提交需要注册的资料清单
4.企业按要求递交相关资料
5.FDA对其进行审批
6.企业根据要求进行整改
7.FDA最终做出决定
8.获得批准k号生效
根据FDA官方的规定,适用的产品代码如下:
1.外科口罩(FXX)
2、带有抗菌剂抗病毒剂的外科口罩(OUK)
3、儿科儿童口罩(OXZ)
4、手术服(FYA)
5、隔离服和或者配件(FYC,LYU,OEA))
6、外科服(FXO)
7、体温计(FLL)
例:额温枪FDA510(k)上市路径